Mục lục
Lịch sử nghiên cứu và phát triển
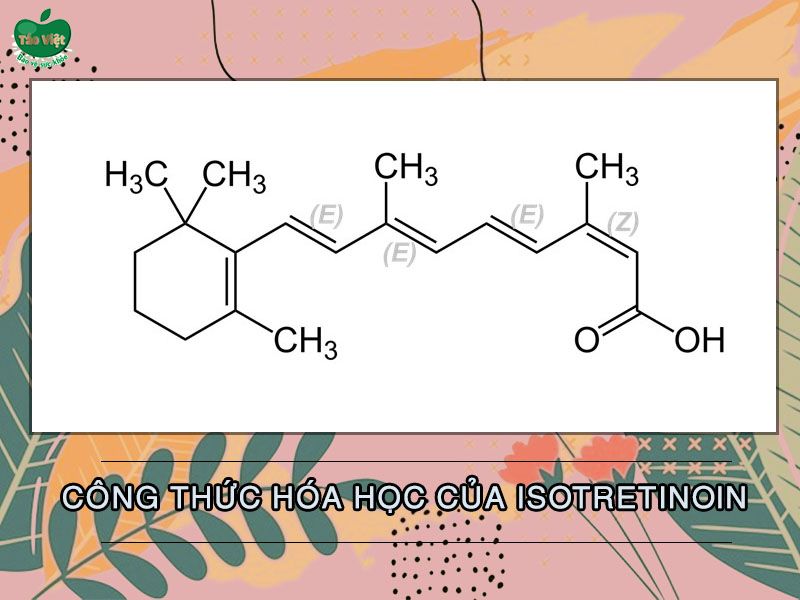
Isotretinoin còn có tên khác là 13-cis-retinoic acid, là một dẫn xuất của vitamin A, được bán dưới tên thương mại đầu tiên là Accutane (Hoffmann-La Roche Inc, Basel, Thụy Sĩ). Hiệu quả cao của điều trị bằng Isotretinoin đối với các loại mụn nặng kháng kháng sinh đã được công nhận rộng rãi. Isotretinoin đường uống lần đầu tiên được Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) phê duyệt điều trị mụn trứng cá nghiêm trọng năm 1982. Cho đến nay, hiệu quả của Isotretinoin vẫn chưa thể bị thay thế bởi bất kỳ phương pháp điều trị nào khác và cho đến tận bây giờ, Isotretinoin vẫn là liệu pháp chống mụn trứng cá hiệu quả nhất trên lâm sàng, tạo ra sự thuyên giảm lâu dài và/hoặc cải thiện đáng kể ở nhiều bệnh nhân.
Tuy nhiên, Accutane không phải là một sản phẩm an toàn. Thuốc gây ra tác dụng phụ nghiêm trọng, đáng chú ý nhất là dị tật bẩm sinh. Sự kết hợp độc đáo 2 yếu tố giữa hiệu quả nhất và rủi ro nhất đã đặt ra một thách thức lớn cho FDA.
Năm 1975, khi các nhà nghiên cứu người Mỹ cho Hoffmann-La Roche bắt đầu nghiên cứu chất hóa học Isotretinoin, họ đã bị ấn tượng mạnh bởi hiệu quả vượt trội của nó. Loại thuốc mà Roche Laboratories bán dưới dạng Accutane là một thuốc kháng mụn trứng cá cực kỳ mạnh mẽ, không thể so sánh với bất kỳ phương pháp điều trị nào khác. 85% bệnh nhân dùng Accutane đã thuyên giảm hoàn toàn sau một đợt điều trị thông thường (khoảng 5 tháng). Vì điều này mà Accutane đã được ca ngợi là một loại thuốc thần kỳ. Năm 2001, FDA Consumer Magazine – tạp chí riêng của FDA – tuyên bố loại thuốc này là “bước đột phá lớn nhất trong điều trị mụn trứng cá trong 20 năm qua”.
Điều này có vẻ như là một sự chú ý quá mức cho một phương pháp điều trị mụn đơn giản, nhưng trên thực tế, mụn trứng cá nghiêm trọng có thể là một tình trạng gây suy nhược nghiêm trọng. Nó có thể để lại những ảnh hưởng đáng kể về cả thể chất lẫn tâm lý: sẹo vĩnh viễn, ảnh hưởng nghiêm trọng đến thẩm mỹ, lo lắng, trầm cảm… Một bệnh nhân được mô tả trong Journal of the American Medical Association (JAMA) đã trở nên rất khó chịu vì ngoại hình của mình, đến nỗi anh ta đã bỏ học đại học. Theo Jennifer Hansen, một người 21 tuổi dùng Accutane, “Loại thuốc này đã trả lại cuộc sống cho tôi… Tôi bây giờ tự tin, hạnh phúc và rất hứng thú với cuộc sống. Tôi không còn cảm thấy thấp kém nữa và thực sự có thể nhìn vào mắt mọi người.”
Kể từ khi phát hành, Accutane đã mang lại doanh thu rất lớn cho nhà tiếp thị của mình là Roche. Thuốc mang lại hơn 700 triệu USD mỗi năm cho đơn vị thuốc kê đơn của công ty tại Thụy Sĩ, Hoffmann-La Roche. Khoảng 12 triệu người trên toàn thế giới (bao gồm 5 triệu người Hoa Kỳ) đã dùng Accutane, còn được gọi là Roaccutane ngoài Hoa Kỳ. Năm 2000, tổng doanh số của Accutane đạt 759.4 triệu USD – 8% tổng doanh số thuốc kê đơn.
Nhưng ngoài những mặt tích cực, Accutane cũng có khả năng hủy hoại sự sống. Accutane là một tác nhân gây quái thai cực kỳ nguy hiểm: Nó có thể gây dị tật bẩm sinh nghiêm trọng khi dùng trong thai kỳ. Khoảng 1/4 trẻ sinh ra đã phơi nhiễm Accutane trong thời kỳ mang thai bị dị tật bẩm sinh lớn. Những đứa trẻ được sinh ra không có dị tật lớn thường bị khuyết tật về học tập nghiêm trọng. Cả một bộ phận trẻ sơ sinh phơi nhiễm Accutane thậm chí không thể sống sót khi mang thai: 40% bị sảy thai tự nhiên.
Khám phá và phê duyệt trước khi ra thị trường: 1970-1982
Hầu hết các thông tin về phát triển, thử nghiệm và phê duyệt của Accutane chỉ bắt đầu xuất hiện 10 năm sau khi thuốc xuất hiện trên thị trường. Người ta có thể đổ lỗi cho Roche: Công ty đã nhiều lần ra tòa yêu cầu tài liệu mô tả phát triển của Accutane phải được giữ kín. Tất nhiên, tất cả các nhà sản xuất đều có quyền giữ bí mật thương mại. Nhưng một số người tin rằng Roche khai thác quyền hạn đó để giữ kín một số chi tiết nhất định – các chi tiết có thể phản ánh kém về công ty – bị che khuất.
Tiến sĩ Werner Bollag lần đầu tiên nghiên cứu hợp chất hóa học 13-cis retinoic acid tại phòng thí nghiệm của Roche ở Thụy Sĩ trong những năm 1960. Bollag đã thử nghiệm hợp chất này để điều trị ung thư da, và năm 1971, đã phát hiện ra hợp chất này có khả năng chữa mụn trứng cá. Nhưng Bollag cũng nhanh chóng nhận ra rằng hợp chất này có thể gây ra dị tật bẩm sinh nghiêm trọng. Hợp chất này có nguồn gốc từ vitamin A, một tác nhân gây quái thai đã biết. Khi nó tỏ ra không hiệu quả trong điều trị ung thư, ông đã từ bỏ dự án. Trong 1 bài báo được trích dẫn thường xuyên từ Retinoids Therapy, Bollag đã giải thích, “Vào thời điểm đó [những năm 1970], trong bầu không khí tâm lý u ám gây ra bởi thảm kịch thalidomide, sẽ không thể tưởng tượng được việc phát triển một tác nhân có đặc tính gây quái thai để điều trị một khiếu nại phổ biến như mụn trứng cá.”
Năm 1975, 2 nhà khoa học tại Viện Y tế Quốc gia (NIH) đã bắt đầu thử nghiệm 13-cis retinoic acid của Hoffmann-La Roche (sau này được biết đến với tên Isotretinoin) để điều trị chứng rối loạn da nghiêm trọng có tên là lamellar ichthyosis (vảy cá phiến mỏng lamellar). Trong nghiên cứu của họ, các bác sĩ Frank Yoder và Gary Peck vô tình phát hiện ra rằng chất hóa học này cũng làm sạch mụn trứng cá. Các bệnh nhân bị nổi mụn đã trở lại văn phòng với một làn da rõ ràng. Ngày 27/11/1976, Yoder và Peck đã công bố phát hiện của họ trên Tạp chí The Lancet. Theo 2 bác sĩ, Hoffmann-La Roche không bao giờ thông báo cho họ về công việc của Werner Bollag. “Tôi không biết gì về các nghiên cứu năm 1971 cho đến năm 1986”, Peck nói sau đó với Columbus Dispatch, “Phản ứng đầu tiên của tôi là tôi không chắc tôi đã tin vào điều đó ngay từ đầu.” Yoder và Peck tin rằng họ là những người đầu tiên phát hiện ra Isotretinoin như một phương pháp trị mụn.
Isotretinoin trở thành Accutane, và trong các thử nghiệm lâm sàng, các nhà nghiên cứu cẩn thận tránh cho phụ nữ mang thai phơi nhiễm với thuốc. Hoffmann-La Roche đã thực hiện các nghiên cứu trên động vật và con cái của chúng, cho thấy dị tật khuôn mặt giống như những gì đã được quan sát thấy ở trẻ sơ sinh phơi nhiễm với Accutane. Những nhà nghiên cứu yêu cầu những đối tượng tham gia là nữ phải có thử thai âm tính và sử dụng biện pháp tránh thai. Trong một bản khai, David Benjamin, người theo dõi các thử nghiệm lâm sàng năm 1977 và 1978, đã cho biết từng có 1 phụ nữ tham gia một thử nghiệm lâm sàng đã mang thai và công ty đã thúc giục bà phá thai. Khi Roche đệ trình Accutane để được FDA chấp thuận tháng 7/1981, công ty đã báo cáo rằng không có trẻ sơ sinh nào bị phơi nhiễm thuốc.
Tháng 1/1982, Ủy ban Tư vấn Thuốc Da liễu (Dermatologic Drugs Advisory Committee) đề nghị FDA chấp thuận Accutane. Nhưng Ủy ban cũng đề xuất rằng nhãn phải được sửa đổi. Trong đơn đăng ký Accutane, Roche đã viết “Sự quái thai quan sát được trên chuột ở liều … 150 mg/ngày. Ở thỏ, liều 10 mg/ngày gây quái thai … và gây sảy thai. Không có nghiên cứu đầy đủ và đối chứng tốt ở phụ nữ mang thai.” Roche đề xuất xếp hạng nguy cơ thai kỳ là C. Có năm loại rủi ro: A, B, C, D và X, và xếp hạng C chỉ ra rằng “các nghiên cứu trên động vật đã cho thấy tác dụng phụ trên thai nhi và không có nghiên cứu đối chứng nào trên phụ nữ… Thuốc chỉ nên được sử dụng nếu lợi ích tiềm năng vượt trội hơn nguy cơ tiềm ẩn đối với thai nhi.” FDA nhấn mạnh rằng Roche cần nâng cấp cảnh báo cho Accutane và phân nó vào loại X, điều này cho thấy nguy cơ trên thai nhi rõ ràng vượt xa mọi lợi ích có thể có từ việc sử dụng thuốc trong thai kỳ.
Rõ ràng, sự vắng mặt của dị tật bẩm sinh là kết quả trực tiếp của các điều kiện thử nghiệm của Hoffmann-La Roche: Tất cả những người tham gia là phụ nữ được thử thai và tránh thai, và một phụ nữ mang thai đã bị phá thai. Mặc dù FDA nâng cao xếp hạng nguy cơ thai kỳ với thuốc, nhãn ban đầu lại không đề xuất các biện pháp phòng ngừa cẩn thận mà chính Roche đã sử dụng trong các thử nghiệm lâm sàng. Thay vào đó, nhãn lại ghi rằng thực tế không có bằng chứng về dị tật bẩm sinh ở người.

Tháng 5/1982, 9 tháng sau khi đơn đăng ký được nộp, FDA đã công bố phê duyệt Accutane. Thuốc đã được phân loại ưu tiên hàng đầu “1A” và được phê duyệt theo dõi nhanh. Theo một phát ngôn viên nữ của Hoffmann-La Roche được trích dẫn trên tờ Washington Post, “Sự chấp thuận được đưa ra quá nhanh đến nỗi nó gây bất ngờ cho tất cả mọi người …” Hoffmann-La Roche mất thêm 4 tháng để chuẩn bị ra mắt thuốc. Hoa Kỳ là quốc gia đầu tiên phê duyệt Accutane.
Tiếp thị sớm: 1984-1987
Tháng 9/1982, Accutane được chào đón nồng nhiệt. “Chưa từng có một loại thuốc nào giống như nó”, Newsweek báo cáo. U.S. News và World Reports tuyên bố rằng Accutane có thể loại bỏ hầu hết các trường hợp bị mụn trong vòng vài tháng. Trong 6 tháng đầu tiên tiếp thị, các bác sĩ đã kê 200,000 đơn thuốc cho Accutane, nhiều hơn cả mong đợi của Hoffmann-La Roche.
Đồng thời, một số bác sĩ đã nghiên cứu loại thuốc này bắt đầu lên tiếng cảnh báo. Bác sĩ Henry J. Roenigk từng là chủ tịch của khoa da liễu tại Đại học Northwestern và tham gia với tư cách là nhà nghiên cứu cho Roche trong các thử nghiệm lâm sàng. Tháng 5/1982 – ngay khi FDA cấp phép – Roenigk đã xuất bản một bài báo trên Journal of Dermatology về nguy cơ gây ra dị tật bẩm sinh của Accutane. Bác sĩ Frank Yoder, 1 trong 2 nhà khoa học của NIH, người dường như đã phát hiện ra phương pháp trị mụn trứng cá, đã viết một lá thư cho JAMA vào tháng 1/1983, “Tôi muốn bày tỏ mối quan tâm và lo lắng của mình về thảm kịch tiềm tàng có thể phát sinh từ việc lạm dụng và sử dụng sai Accutane … Độc tính tiềm tàng của loại thuốc này đã được nhấn mạnh không đúng mức nghiêm trọng.”
Hoffmann-La Roche đã chỉ trích các nhà khoa học vì đã tiết lộ thông tin thu được khi làm việc cho công ty. Yoder tuyên bố rằng ông đã nhận được một cuộc gọi không thân thiện từ các giám đốc điều hành của Roche. Theo ông, đại diện của Roche đã “giận dữ nói với tôi rằng tôi không nên viết những thông tin bí mật đó. Tôi đã không đồng ý với họ…” Ngay sau đó, công ty đã gửi thư cho tất cả các nhà khoa học đã tham gia các thử nghiệm lâm sàng, nhấn mạnh tính bảo mật của thông tin thu được trong quá trình nghiên cứu do Hoffmann-La Roche tài trợ. Trong một phiên tòa năm 1996, một nhân viên của Roche đã làm chứng, “Một điều tra viên đã viết một bài viết và chúng tôi muốn nhấn mạnh lại với tất cả các nhà điều tra rằng thông tin họ nhận được là bí mật.”
Trong vòng vài tháng, Hoffmann-La Roche bắt đầu nhận được những câu chuyện về những đứa trẻ sinh ra bị dị tật bẩm sinh nghiêm trọng với những phụ nữ đã sử dụng Accutane. Tháng 6 năm 1983 – 9 tháng sau khi thuốc được phát hành – 3 trường hợp đã được báo cáo cho Roche. Công ty đã nhanh chóng gửi một bức thư cho các bác sĩ, cảnh báo về những nguy hiểm khi sử dụng Accutane khi mang thai. Tháng 8 năm đó, FDA đã xuất bản một bài báo trên tạp chí The Lancet mô tả 12 trường hợp được báo cáo về “kết quả mang thai bất lợi” được quy kết là do Accutane. Roche đã phân phối các nhãn dán cảnh báo màu đỏ cho các hiệu thuốc để cảnh báo các hộp đựng Accutane và gửi bức thư thứ hai cho 500,000 bác sĩ. Công ty cũng sửa đổi nhãn thuốc bao gồm thêm thông tin về dị tật bẩm sinh và cảnh báo được đặt nổi bật hơn.
Tháng 9/1983, tổ chức ủng hộ tích cực Public Citizen kiến nghị FDA điều chỉnh thêm nhãn của Accutane. Nhóm nghiên cứu sức khỏe của Public Citizen cho rằng các cảnh báo về thuốc là không đủ và do đó Accutane đã được kê đơn quá mức. Nhóm yêu cầu một cảnh báo mô tả khả năng dị tật bẩm sinh, sảy thai tự nhiên, bệnh Chrohn và một số vấn đề sức khỏe nghiêm trọng khác. Ngoài ra, Public Citizen yêu cầu FDA đặt gói chèn cho bệnh nhân giải thích các tác dụng phụ bằng ngôn ngữ phi kĩ thuật. FDA đã từ chối yêu cầu của Public Citizen.
Trong 18 tháng đầu tiên tiếp thị, khoảng 400,000 bệnh nhân đã dùng Accutane. Đến tháng 3/1984, Roche đã thu thập báo cáo của 20 em bé phơi nhiễm Accutane. Ủy ban Tư vấn Thuốc Da liễu đã triệu tập một cuộc họp để giải quyết vấn đề.
Theo khuyến nghị của Ủy ban, FDA đã yêu cầu Roche tăng cường hơn nữa cảnh báo của Accutane về các dị tật bẩm sinh. Nhãn cần đề xuất rõ ràng rằng bệnh nhân cần sử dụng biện pháp tránh thai 1 tháng trước khi điều trị. Roche cũng đưa ra một “Medical Director’s Page” trong JAMA để thông báo cho các bác sĩ có thể kê đơn thuốc. Ngoài ra, FDA còn khuyên các ngân hàng máu từ chối nhận máu hiến từ người dùng Accutane. Mặc dù theo tiêu chuẩn ngày nay thì chúng vẫn còn rất nhẹ, nhưng các biện pháp kiểm soát này được coi là “hành động pháp lý chưa từng có”, theo người phát ngôn của FDA William Grigg.
Từ năm 1984 đến 1988, Roche đã gửi thêm 7 bức thư cho các bác sĩ để cảnh báo về Accutane. Tháng 6/1985, FDA và Roche một lần nữa nâng cấp sự thận trọng trên nhãn, lần này bao gồm một cảnh báo hộp đen như Public Citizen đã yêu cầu năm 1983. Vào thời điểm đó, cảnh báo hộp đen là chỉ thị nghiêm trọng nhất mà FDA sử dụng mà không cần phải thu hồi. Các bác sĩ đang hành nghề đã đề xuất rằng FDA yêu cầu cảnh báo hộp đen khi họ hy vọng sẽ giảm doanh số bán thuốc. Nhưng trong những năm sau đó, đơn thuốc có Accutane vẫn phổ biến và các báo cáo về những em bé bị dị tật nghiêm trọng vẫn tiếp tục lộ diện.
Sống sót trước nguy cơ bị thu hồi: 1988-1995
Trong một bản ghi kín ngày 11/2/1988, một số nhà khoa học thuộc Phòng Dịch tễ học (Division of Epidemiology) của FDA đã kêu gọi cơ quan này tích cực xem xét việc đưa Accutane ra khỏi thị trường. “Tất cả các nỗ lực cho đến nay đã không thành công trong việc bảo vệ chống lại phơi nhiễm thai kỳ, các di chứng của dị tật bẩm sinh và sảy thai.” Dựa trên các nghiên cứu về các bệnh nhân Michigan Medicaid, các tác giả, bác sĩ David Graham, Franz Rosa và Carlene Baum, ước tính có khoảng 900 đến 1300 em bé phơi nhiễm Accutane đã được sinh ra ở Hoa Kỳ. FDA đã nhận được báo cáo chỉ có 62 trẻ sơ sinh bị dị tật. Vào tháng 3, Trung tâm Kiểm soát Dịch bệnh (CDC) đã công bố một báo cáo mô tả 4 trường hợp ở New Jersey có nhiều dị tật bẩm sinh nghiêm trọng phơi nhiễm với Accutane trước khi sinh. FDA đã lên lịch một cuộc họp của Ủy ban Tư vấn Thuốc Da liễu vào cuối tháng 4.
Ngày 22/4, 4 ngày trước cuộc họp theo lịch trình, một báo cáo trong bản ghi bí mật của FDA đã xuất hiện trên trang nhất của New York Times. Ai đó đã làm rò rỉ tài liệu. Tin tức về số lượng lớn trẻ sơ sinh ước tính phơi nhiễm Accutane – kết hợp với số lượng lớn các ca sẩy thai được cho là do thuốc gây ra – đã gây ra một cơn sốt chú ý của truyền thông. Các nhà báo đặt câu hỏi liệu nhà sản xuất và các bác sĩ có đẩy thuốc đi quá xa và liệu FDA có phê duyệt thuốc quá nhanh hay không. Đại diện New York, Ted Weiss công khai kêu gọi FDA hạn chế sử dụng thuốc. Weiss cũng đặt câu hỏi cho câu trả lời của cơ quan này, “Tại sao FDA lại tiến hành chỉ để sắp xếp một cuộc họp ủy ban tư vấn khác? … Chúng tôi không cho phép sử dụng quy trình của ủy ban tư làm lời xin lỗi để cho phép một loại thuốc gây dị tật bẩm sinh nghiêm trọng như vậy vẫn còn tồn tại thị trường.” Một ngày sau đó, Hoffmann-La Roche đã xen vào, cho rằng nghiên cứu ở Michigan “về cơ bản là vô nghĩa” và gọi các số liệu là bị “cường điệu quá mức”. Công ty lập luận rằng dữ liệu đã được lấy từ cỡ mẫu quá nhỏ để có thể ngoại suy và đã bị FDA giải thích sai. Bác sĩ Frank Yoder, hiện không có quan hệ nào với Hoffmann-La Roche, đã đưa ra một tuyên bố với Washington Post, gọi công ty là “cẩu thả và sai lầm” vì quảng cáo thuốc quá mức cho các bác sĩ không thuộc chuyên khoa da liễu. Yoder cũng mô tả các biện pháp an toàn mạnh mẽ đã được áp dụng trong quá trình thử nghiệm để đảm bảo rằng không có phụ nữ mang thai nào phơi nhiễm với thuốc. “Thật khó tin khi yêu cầu điều đó trong một nghiên cứu mà không phải là trong tình hình tiếp thị đại chúng … Điều này rất, rất sai.” Các lãnh đạo của Hoffmann-La Roche đã “giận dữ bác bỏ” trách nhiệm của Yoder.
Một nguồn gây tranh cãi là sự chênh lệch giữa việc sử dụng Accutane ở Hoa Kỳ và các quốc gia khác. Tính đến ngày 30/4/1988, chỉ có 3 em bé phơi nhiễm với Accutane được sinh ra ở Châu Âu. Một bác sĩ chuyên khoa da liễu ở Anh nhận xét, “Trải nghiệm của Hoa Kỳ là một điều khiến chúng tôi kinh hoàng”. Hầu hết các nước ở châu Âu đều hạn chế sử dụng thuốc. Tại Thụy Sĩ, các bác sĩ đã phải đăng ký với chính phủ để có thể kê đơn. Tại Vương quốc Anh, chỉ có 350 bác sĩ chuyên khoa da liễu có thẩm quyền kê đơn Accutane và chỉ có các bệnh viện mới có thể phân phối nó. Như một điều kiện tiên quyết để được nhận thuốc ở Anh, một người phụ nữ đã phải cam kết rằng cô ấy sẽ sẵn sàng phá thai. Thụy Điển không bao giờ phê duyệt Accutane cho sử dụng chung, bác sĩ chuyên khoa da liễu muốn sử dụng phải xin phép khi bệnh nhân có nhu cầu đặc biệt. Tại Tây Ban Nha, Bộ Y tế đã giữ tên và địa chỉ của mọi phụ nữ dùng Accutane trong một cuốn sổ đặc biệt. Cách tiếp cận của Châu Âu với Accutane phản ánh không chỉ một phương pháp điều chỉnh khác nhau, mà còn là những trường hợp khác nhau. Sau Thalidomide, người châu Âu cực kỳ thận trọng với tất cả các loại thuốc gây quái thai. Theo bác sĩ chuyên khoa da liễu người Anh trích dẫn ở trên, “Đây là một nhóm các bác sĩ đã tồn tại qua thời Thalidomide, chúng tôi cẩn thận hơn nhiều khi sử dụng Accutane.” Những người ủng hộ như Public Citizen chỉ ra số lượng nhỏ những dị tật bẩm sinh liên quan đến Accutane ở nước ngoài là bằng chứng cho việc sử dụng thuốc hạn chế.
Cuộc họp của Ủy ban ngày 26/4 cũng gây tranh cãi như cuộc tranh luận công khai trước đó. Một người xem nhận xét rằng các bác sĩ đã chia thành hai phe rõ ràng: Các bác sĩ da liễu vs. các bác sĩ nhi khoa. Mọi người đều đồng ý rằng Accutane gây ra dị tật bẩm sinh, nhưng các bác sĩ da liễu khẳng định rằng vì nó rất hiệu quả, và vì việc điều trị có thể giới hạn trong một vài tháng, nên vẫn nên duy trì thuốc trên thị trường. Hoffmann-La Roche đề xuất một chương trình giáo dục tích cực để giảm nguy cơ mang thai. Bác sĩ J. David Erickson của CDC đã từ chối chiến thuật này, “cách tiếp cận hiện tại … đã thất bại.” Ông đề nghị loại thuốc này chỉ nên được phân phối tại một số trung tâm vùng hạn chế. Những người khác từ Phòng Dịch tễ học đã đưa ra bằng chứng cho thấy loại thuốc này được “kê đơn quá mức rõ ràng.” Cuối cùng, Ủy ban đã bỏ phiếu 4-3 để giữ Accutane trên thị trường nhưng sử dụng hạn chế. Ủy ban khuyến nghị rằng chỉ một số lượng giới hạn các bác sĩ được chứng nhận mới được phép phân phối thuốc. Ngoài ra, phụ nữ có nguy cơ mang thai cao sẽ được yêu cầu đưa ra ý kiến thứ hai trước khi nhận Accutane.
1 tháng sau, FDA tuyên bố rằng họ sẽ không tuân theo khuyến nghị của Ủy ban về hạn chế sử dụng Accutane. Khi được hỏi liệu họ có thẩm quyền chỉ thị ai có thể kê đơn hay không, FDA thay vào đó đã đưa ra các cảnh báo mới trên nhãn. Cơ quan này yêu cầu Hoffmann-La Roche cung cấp các mẫu đơn đồng ý được ký bởi bệnh nhân và bác sĩ. Ngoài ra, FDA đã chỉ đạo công ty phải tăng gấp đôi kích cỡ cảnh báo, bao gồm hình ảnh của một em bé bị dị tật bởi Accutane trong các tài liệu cho bệnh nhân, phân phối thuốc trong bao bì với cảnh báo trên mỗi gói, hướng dẫn các bác sĩ rằng họ nên đưa ra các cảnh báo bằng văn bản và lời nói, thêm một biểu tượng phụ nữ mang thai bị gạch bỏ trên các tài liệu cho bác sĩ và bệnh nhân và tiến hành các nghiên cứu tiếp theo để xác định hiệu lực của chương trình mới. Một lần nữa, Accutane đã thúc đẩy FDA đưa ra “một biện pháp mới khác thường”, biện pháp mà chính cơ quan này mô tả là “chưa từng có”, và là “một cách tiếp cận rất ấn tượng và sáng tạo”.

Hoffmann-La Roche tuyên bố rằng họ sẽ tuân thủ các yêu cầu của FDA. Ngoài ra, công ty đề nghị thanh toán chi phí tư vấn tránh thai và thử thai cho bất kỳ phụ nữ nào nhận đơn có Accutane. Các nhà nghiên cứu tại Đơn vị Dịch tễ học Slone thuộc Trường Y tế Công cộng Đại học Boston đã tranh thủ nghiên cứu hiệu lực của chương trình theo lệnh của FDA.
Các cuộc tranh luận tiếp tục trong suốt năm 1989. Ngày 8/5/1989, Ủy ban Tư vấn Thuốc Da liễu họp lần nữa để thảo luận về Accutane. Nhóm đã chấp nhận ý kiến từ các đại diện của Teratology Society of America, Association for Retarded Citizens of the U.S., March of Dimes, Accutane Litigation Group và American Academy of Pediatrics. Các bác sĩ da liễu đã đưa ra hình ảnh của những bệnh nhân bị mụn trứng cá cực kỳ nghiêm trọng và được chữa khỏi bằng Accutane. Các nhà dịch tễ học tại CDC bày tỏ “mức độ quan tâm sâu sắc mà chúng tôi cảm thấy … về tỷ suất sử dụng rất cao đang diễn ra.” Đã có nhiều giờ tranh cãi về những con số. Các thành viên của Ủy ban đồng ý rằng còn quá sớm để đánh giá thành công của Roche trong việc giảm mang thai – Chương trình Dự phòng Thai kỳ (Pregnancy Prevention Program) của họ chỉ mới kéo dài 6 tháng. FDA sẽ tiếp tục theo dõi tình hình.
Vào mùa thu, một cuộc chiến đã nổ ra ở các trang sau của New England Journal of Medicine (NEJM). Robert Stern, một bác sĩ chuyên khoa da liễu ở Boston, đã viết một bài báo mô tả Accutane là phương pháp điều trị hiệu quả duy nhất cho mụn trứng cá. Ông cũng mô tả các dị tật bẩm sinh do thuốc gây ra và phác thảo Chương trình Dự phòng Thai kỳ mới của Roche, nhận xét về “gánh nặng đáng kể” đặt trên vai các bác sĩ. Stern kết luận, “Thành công của chúng tôi khi đối mặt với thách thức của (Accutane) sẽ rất quan trọng trong việc xác định liệu [các loại thuốc hiệu quả có thể gây dị tật bẩm sinh khác] có trở nên có sẵn hay không và chúng được sử dụng như thế nào.” Số ra ngày 14/9 của NEJM có một số phản hồi giận dữ với tác phẩm của Stern. Sidney Wolfe và Andrew Holmes từ Public Citizen đã khiển trách Stern vì đã bỏ qua việc tiết lộ “mối quan hệ đáng kể của anh ta với Hoffmann-La Roche”, và cho rằng những con số được lấy từ Nghiên cứu Slone là không chính xác. Tương tự như vậy, bác sĩ Gerald Faich và Franz Rosa lập luận rằng có lẽ đã có nhiều em bé bị phơi nhiễm Accutane hơn số được báo cáo. Họ than thở: “Thật đáng thất vọng khi có ít sự thay đổi xảy ra trong tỷ suất sử dụng thuốc ở phụ nữ, bất chấp những nỗ lực công khai đáng kể để giáo dục các bác sĩ.” Stern trả lời lưu ý rằng NEJM đã biết về mối liên hệ của ông với Roche (một sự thật được xác nhận bởi tổng biên tập).
8 tháng sau, Ủy ban Tư vấn Thuốc Da liễu đã họp với Ủy ban Tư vấn Thuốc Sinh sản và Sức khỏe Bà mẹ (Fertility and Maternal Health Drugs Advisory Committee) để thảo luận về Accutane. FDA đã yêu cầu 2 nhóm giải quyết câu hỏi này: Tình hình sức khỏe cộng đồng bất lợi trước năm 1988 đã thay đổi theo một cách có ý nghĩa và đạt đến mức độ có ý nghĩa hay chưa? Các Ủy ban thấy rằng câu trả lời là chưa. Mức độ sử dụng Accutane cao liên tục trong quần thể có nguy cơ, người kê đơn không tuân thủ các thành phần quan trọng của chương trình (nhiều phụ nữ trong độ tuổi sinh sản thậm chí chưa được thử thai trước khi bắt đầu điều trị) và mức độ tham gia tương đối thấp khảo sát Slone đặt ra mối quan tâm đáng kể cho nhóm. Nhưng ban cố vấn đã quyết định cho Hoffmann-La Roche thêm 7 tháng nữa để chứng minh hiệu lực của Chương trình Dự phòng Thai kỳ.
Thực sự phải mất tới 12 tháng để các ủy ban triệu tập lại – cuộc họp chung được tổ chức vào tháng 5/1991 – và khi các nhóm tập hợp lại, sự chú ý của truyền thông đã biến mất. Không giống như 3 cuộc họp liên quan đến Accutane trước đây, cuộc họp lần này không nhận được tin tức nào trên tờ Washington Post hay New York Times. Cũng trái ngược với các cuộc họp trước đó, lần này người ta thấy rằng các can thiệp của Hoffmann-La Roche đã đạt kết quả. Các thành viên ủy ban đã nghe dữ liệu từ nghiên cứu Slone chỉ ra rằng số phụ nữ có thể sinh con dùng Accutane đã giảm. Nghiên cứu Slone cho thấy tỷ lệ mang thai là 3.6 trên 1000 phụ nữ sử dụng Accutane. Và trong số những phụ nữ đã mang thai, 28% cho biết họ đã phá thai bằng thuốc, tỷ lệ tương đương với dân số chung. Ngày càng có nhiều bác sĩ thực hiện các xét nghiệm thử thai trước khi kê đơn. Kể từ năm 1988, khoảng 20% phụ nữ xem xét điều trị bằng Accutane sử dụng bộ kit của chương trình đã bị loại. Số báo tháng 9/1991 của FDA Consumer đã thông báo rằng Chương trình Dự phòng Thai kỳ “có vẻ đang hoạt động”.
Cùng với đó, Accutane rời khỏi mắt công chúng và ra khỏi chương trình nghị sự của FDA. Sẽ không còn các cuộc họp của Ủy ban Tư vấn Thuốc Da liễu dành riêng cho Accutane những năm 1990. Năm 1995, NEJM đã công bố kết quả khảo sát Slone dường như cho thấy Chương trình Dự phòng Thai kỳ đã thành công. Chỉ có 402 trong số 120,000 phụ nữ tham gia khảo sát báo cáo có thai. Cuộc khảo sát chỉ theo dõi khoảng một nửa số phụ nữ sử dụng Accutane, do đó nó không thể được coi là kết luận chính thức. Tuy nhiên, một bài xã luận được xuất bản cùng với bài báo đã nhận xét rằng nó cung cấp “một số tin tức đáng khích lệ”. Có vẻ như vấn đề của những em bé phơi nhiễm Accutane sẽ sớm kết thúc.
Xung đột yên tĩnh hơn: 1992-1999
Ra khỏi sự chú ý, Hoffmann-La Roche tiếp tục vật lộn với những hậu quả của dị tật bẩm sinh liên quan đến Accutane. Giữa những năm 1990, Accutane đã mang lại cho công ty một danh sách kẻ thù đáng kể. Frank Yoder, theo một cách nào đó, người bảo trợ của Hoffmann-La Roche, sau tất cả, khám phá năm 1976 của ông đã tạo ra một công cụ kiếm tiền khổng lồ cho công ty mà ông đã dành 15 năm qua để lăng mạ Roche trên tờ Washington Post. Công ty đã phải giải quyết một số vụ kiện đắt tiền. Nhóm ủng hộ Public Citizen đã phàn nàn về Accutane từ năm 1983. Theo thời gian, nhóm trở nên thất vọng vì sự tự mãn của FDA và thuyết phục về khả năng phạm tội của Roche. Năm 1996, mỗi trong số 3 đối thủ đã đưa Hoffmann-La Roche ra tòa.
Ngày 12/1/1996, Bác sĩ Frank Yoder đã tài trợ cho một quảng cáo trên tờ báo Columbus, Ohio The Daily Reporter: “ĐẤU GIÁ KÍN ĐỘC NHẤT”. Toàn bộ bộ sưu tập cá nhân của Frank W. Yoder M.D. liên quan đến việc phát triển, sử dụng và lạm dụng ISOTRETINOIN (Accutane) sẽ được bán trong một cuộc đấu giá đấu giá kín.
Việc mua bán này bao gồm các tài liệu liên quan đến giao thức gốc, thư từ các nhà điều tra châu Âu và một bản thảo chưa từng được phân phối hoặc xuất bản có tiêu đề, “Isotretinoin Birth Defects – A Preventable Tragedy.”
Các cá nhân, tập đoàn và tất cả các bên nghiêm túc khác được mời tham gia vào sự kiện độc đáo và duy nhất này. Giá thầu tối thiểu là 9.5 triệu USD và 20% số tiền thu được sẽ được sử dụng để ngăn ngừa dị tật bẩm sinh.
Ngày 11/2, một quảng cáo tương tự đã xuất hiện trên tờ Washington Post.
Công ty đã kiện Yoder tại tòa án liên bang, yêu cầu một lệnh cấm đấu giá và bãi bỏ các tài liệu đem bán. “Hầu hết các tài liệu liên quan đến chi tiết bí mật thương mại của nghiên cứu và thử nghiệm Hoffmann-La Roche đã thực hiện trước khi thuốc được FDA chấp thuận để bán cho công chúng”, luật sư của Roche, Karl Seib nói. “Những bí mật thương mại này sẽ vô cùng quý giá đối với các đối thủ cạnh tranh của Hoffmann-La Roche.” Seib tuyên bố rằng Yoder đang cố gắng “đe dọa” công ty mua lại tài liệu (Yoder đã gọi cho đại diện của Roche để thông báo cho họ về cuộc đấu giá vài ngày trước khi chạy quảng cáo). Yoder lập luận rằng tài liệu này không liên quan đến bí mật thương mại, mà thay vào đó là khả năng phạm tội của Roche trong các trường hợp dị tật bẩm sinh liên quan đến Accutane. Trong bản tóm tắt của mình cho tòa án, luật sư của Yoder đã viết “Tập hợp thông tin của bác sĩ Yoder là độc nhất ở chỗ nó cho thấy sự bất cẩn và tham lam của Roche trong việc tiếp thị sớm Accutane. Những thông tin như vậy được thừa nhận có giá trị với các nạn nhân của những cảnh báo sớm không đầy đủ của Roche.”
Các luật sư của Roche cũng xuất hiện tại một tòa án khác ở Ohio trong nỗ lực che giấu các tài liệu khỏi các luật sư của các nguyên đơn. Năm 1994, Fetterolfs đã đệ đơn kiện Hoffmann-La Roche đòi tiền bồi thường do các dị tật bẩm sinh liên quan đến sự phơi nhiễm Accutane ở con trai của họ. Các luật sư của Fetterolfs đã xem xét lại gần 40,000 tài liệu tại các văn phòng của Hoffmann-La Roche ở New Jersey. Ngày 29/4/1996, các nguyên đơn đã yêu cầu tòa án gỡ bỏ lệnh bảo vệ cho 9.000 tài liệu bổ sung. Các nguyên đơn nghi ngờ rằng công ty đã giữ kín thông tin: Họ không thể tìm thấy bất kỳ thư từ nào giữa các nhân viên của Hoffmann-La Roche ở Hoa Kỳ và những người làm việc tại công ty mẹ ở Thụy Sĩ. Các nguyên đơn cho rằng loại thuốc này đã gây ra dị tật bẩm sinh khi thử nghiệm ở Thụy Sĩ và Roche đã giữ kín thông tin từ FDA và các nhà nghiên cứu ở Hoa Kỳ. Frank Yoder lặp lại cáo buộc này khi ông làm chứng trong vụ án của chính mình ngày 24/4. Ông tuyên bố rằng các thử nghiệm Accutane ở châu Âu đã bị dừng lại khi chúng dẫn đến dị tật bẩm sinh nghiêm trọng.
Theo người phát ngôn của Roche, công ty không chắc rằng Accutane gây ra dị tật bẩm sinh cho đến khi các trường hợp đầu tiên được báo cáo vào tháng 6/1983. Accutane có nguồn gốc từ vitamin A, “đã được biết là một chất gây quái thai từ những năm 60”, người phát ngôn nói, “Đó là lý do tại sao nó được phân loại X trên nhãn khi chúng tôi ra mắt thuốc. Và đó cũng là lý do tại sao cần phải có tất cả các yêu cầu nghiêm ngặt trong các thử nghiệm.”
Đại diện của Roche đã khai rằng họ từ chối truy cập vào 9000 tài liệu vì Fetterolf sẽ không ký lệnh bảo vệ. Hoffmann-La Roche cho rằng lệnh này là cần thiết để bảo vệ bí mật thương mại của công ty. Nhưng không giống như những nạn nhân đi trước họ, Fetterolf đã từ chối:
Hoffmann-La Roche đã được phép gây ra tổn hại không thể khắc phục cho nhiều trẻ em nhờ vào các chiến thuật sử dụng để ngăn chặn phổ biến sự thật. Công chúng được quyền biết sự thật và (chúng tôi) sẽ thúc giục tòa án gỡ bỏ áo choàng bí mật mà (Hoffmann-La Roche) cố gắng che giấu.
Số phận các tài liệu bí mật của Roche cuối cùng sẽ được quyết định bởi một tòa án thứ ba ở New Jersey. Năm 1986, cha mẹ của Marvin Hammock đã kiện Roche vì dị tật do Accutane gây ra. Các bên giải quyết các tài liệu thu được bởi Hammocks trong quá trình khám phá đã được niêm phong theo yêu cầu của Roche. Public Citizen can thiệp vào vụ kiện, thách thức quyết định niêm phong các tài liệu. Ban đầu, Tòa thượng thẩm đã đưa ra phán quyết tóm tắt cho Roche. Vụ án đã trải qua xử phúc thẩm và xét xử thêm 2 lần nữa trước khi đến Tòa án Tối cao New Jersey. Tòa án đó cho rằng các tài liệu nên được công bố trừ khi Roche có thể cho thấy lý do chính đáng để từ chối. Ngày 9/5/1996, Tòa thượng thẩm hạt Hudson đã ra lệnh hủy niêm phong tài liệu này. Khi công bố quyết định của mình cấp quyền truy cập chung, Thẩm phán Gallipoli đã nhận xét, “Khá thẳng thắn … Tôi không nghĩ rằng những tài liệu này chỉ là những thứ lặt vặt.”
Đánh giá của Thẩm phán Gallipoli đã chứng minh sự thật: Các tài liệu không cung cấp bằng chứng mà Public Citizen và các luật sư của nguyên đơn đã mong đợi. Hồ sơ cho thấy trong vòng 1 năm phát hành thuốc ra thị trường, các lãnh đạo công ty đã vô cùng lo lắng về dị tật bẩm sinh liên quan đến Accutane và em bé phơi nhiễm Accutane đầu tiên chào đời ngày 29/4/1983. Một bản ghi ghi lại cuộc trò chuyện qua điện thoại giữa John Burns, phó chủ tịch nghiên cứu của Roche và bác sĩ Oakley tại CDC: “Burn nói với Oakley rằng Roche sẽ khuyến nghị rằng bất kỳ phụ nữ nào phơi nhiễm với Accutane khi mang thai đều nên phá thai”. Ngoài ra, lần đầu tiên các bài báo cho thấy Roche đã đăng ký cho Accutane xếp hạng rủi ro thai kỳ là C, và FDA đã khăng khăng muốn tăng mức cảnh báo. Nhưng các tài liệu không chứa bằng chứng liên lạc giữa các văn phòng ở New Jersey và nhà nghiên cứu ở châu Âu.
Tháng 1 tiếp theo, khi Yoder giành chiến thắng trong cuộc chiến pháp lý, tài liệu trị giá 9.5 triệu USD của ông ta đã gây thất vọng không kém. Không có gì trong bộ sưu tập của Yoder cung cấp bằng chứng cụ thể về những đứa trẻ phơi nhiễm Accutane được sinh ra trước năm 1983.
Các tài liệu thú vị nhất nổi lên trong giai đoạn này đến từ một tờ báo Ohio, Columbus Dispatch. Dispatch là ấn phẩm lớn duy nhất đề cập đến loạt vụ kiện liên quan đến Accutane năm 1996. Do cáo buộc của Yoder, 2 phóng viên Mark Somerson và Jill Riepenhoff đã bắt đầu cuộc điều tra riêng về việc phát triển và tiếp thị sớm Accutane.
2 người là những người đầu tiên báo cáo về sự nhầm lẫn người đầu tiên phát hiện ra khả năng điều trị mụn trứng cá nghiêm trọng của Accutane. Vai trò của bác sĩ Werner Bollag trong lịch sử thuốc đã được biết đến từ khi xuất bản bài báo năm 1983 trong Retinoids Therapy, nhưng những người xem xét vấn đề này đã tự hỏi tại sao Hoffmann-La Roche lại đột nhiên quyết định xem xét lại Accutane như một thuốc điều trị mụn trứng cá vào năm 1975 – 4 năm sau khi Bollag từ bỏ dự án của mình. Ví dụ, chủ tịch Diane Nygaard của Accutane Litigation Group đã mô tả quyết định của Roche tiếp tục thử nghiệm là “không thể giải thích được”. Somerson và Riepenhoff đã phát hiện ra một phần của lời giải thích: Công ty bắt đầu thử nghiệm lại sau khi Yoder và Peck độc lập nhận ra rằng loại thuốc này có thể được sử dụng để điều trị mụn trứng cá và đã báo cáo thành công của họ.
Một số thành viên của FDA cảm thấy cơ quan này nên có vị thế mạnh hơn chống lại Hoffmann-La Roche. David Graham, một trong những tác giả của nghiên cứu Michigan Medicaid gây tranh cãi, đã chỉ trích thay đổi ghi nhãn đề xuất của Roche tháng 10/1988. Công ty đã sửa nhãn để đọc, “có khả năng tất cả các thai nhi đều có thể bị ảnh hưởng,” và “các bác sĩ và bệnh nhân nên thảo luận về mong muốn tiếp tục mang thai.” Graham cho rằng Roche cố tình phóng đại nguy cơ dị tật bẩm sinh. “Hiệu quả được truyền đạt từ cách nói này đến bệnh nhân và bác sĩ là nguy cơ dị tật bẩm sinh nghiêm trọng là 100% và nên thực hiện phá thai.” Theo báo cáo của Somerson, 4 bác sĩ tại FDA theo dõi Accutane đã lặp lại mối quan tâm của Graham: “Cách ghi nhãn sản phẩm hiện tại phục vụ lợi ích của Roche bằng cách giảm số lượng phụ nữ sinh đẻ và điều này làm giảm khả năng FDA sẽ được thông báo về phơi nhiễm, vì số lượng lớn không được báo cáo … Công ty đã không hành động một cách trung thực để trả lời chính xác các câu hỏi liên quan đến việc sử dụng Accutane ở phụ nữ và phơi nhiễm khi mang thai.” Những người khác tại cơ quan này cảm thấy quan trọng là truyền đạt nguy cơ đáng kể và thai nhi bị phơi nhiễm thì nên bỏ.
Báo cáo của Somerson cũng mô tả các cuộc tranh luận rõ ràng hơn trong cơ quan này. Ngày 8/5/1989, một thành viên của Ủy ban Tư vấn Thuốc Da liễu đã cáo buộc Graham sử dụng “các phương pháp ra quyết định của Đức Quốc xã” với Accutane. Trong khi đó, Graham chỉ trích cấu trúc pháp lý được FDA sử dụng.
Các bác sĩ chuyên khoa da liễu kê đơn phần lớn (Accutane), và phần lớn vấn đề với (Accutane) liên quan đến việc sử dụng rộng rãi vượt ra ngoài chỉ định trên nhãn … Nó vượt xa mong đợi thông thường để tin rằng một ủy ban của các bác sĩ da liễu sẽ thấy có lỗi với nghề nghiệp của mình, hoặc khuyến nghị rằng (Accutane) nên được loại bỏ khỏi thị trường như một mối nguy hiểm sắp xảy ra … Theo nghĩa này, trình bày (Accutane) cho ủy ban da liễu có phần giống với khái niệm “con cáo trong chuồng gà”.
Với một số thành viên của FDA, vấn đề dị tật bẩm sinh do Accutane gây ra đã đưa ra những câu hỏi cơ bản về phương pháp điều chỉnh của cơ quan này.
Nhưng các phóng viên không thể phát hiện ra bằng chứng về kiến thức thực tế của Roche về các dị tật bẩm sinh do Accutane gây ra trước năm 1983. Cuối cùng, Somerson và Riepenhoff đã từ bỏ cuộc điều tra.
Mặc dù Frank Yoder, Public Citizen, Accutane Litigation Group và Columbus Dispatch đều không đưa ra được bằng chứng thiết lập Hoffmann-La Roche đã giữ kín dữ liệu từ FDA, họ đã phát hiện ra một số hành vi nghi vấn. Tại sao Hoffmann-La Roche đề xuất xếp hạng rủi ro thai kỳ chỉ là C cho một sản phẩm nguy hiểm đến nỗi điều tra viên ban đầu đã từ bỏ nó? Và tại sao công ty đã chia sẻ thông tin về nghiên cứu trước đó với các nhà khoa học ở Hoa Kỳ nghiên cứu thuốc năm 1975? Có phải FDA đã phục vụ cho nhà sản xuất thay vì bảo vệ công chúng? Hay một vài thành viên – đã bị ám ảnh bởi một vài thù địch cá nhân – khuấy động xung đột không cần thiết tại cơ quan?
Các thông tin được phát hiện không bao giờ kết hợp thành một câu chuyện đủ để thu hút sự chú ý chính thống. Bên ngoài Ohio, hầu hết người Mỹ vẫn không biết về những rắc rối pháp lý đang diễn ra của Hoffmann-La Roche. Do đó, công ty và FDA đã thoát khỏi sự giám sát.
Tiếp tục điều chỉnh: 1999-2002
Trong vài năm qua, FDA và các tổ chức chính phủ khác đã xem xét lại Accutane, đặt câu hỏi liệu có nên làm nhiều hơn nữa để bảo vệ chống lại dị tật bẩm sinh do Accutane gây ra hay không. Mặc dù Chương trình Dự phòng Thai kỳ của Roche đã thành công trong duy trì tỷ lệ mang thai rất thấp (2.7 trên 1000 phụ nữ sử dụng Accutane), số bệnh nhân sử dụng Accutane tăng đều sau năm 1991. Từ năm 1992 đến 1999, số lượng đơn thuốc Accutane tăng 200%. Mặc dù nguy cơ phơi nhiễm thai kỳ với bất kỳ phụ nữ nào sử dụng Accutane đã giảm, nhưng tổng số trẻ sơ sinh phơi nhiễm Accutane vẫn không đổi vì sử dụng nhiều hơn.
CDC báo hiệu sự quan tâm mới với trẻ sơ sinh phơi nhiễm Accutane ngày 21/1/2001 trong Báo cáo Hàng tuần Tỷ suất bệnh và Tử vong. Mục “Accutane-Exposed Pregnancies – California, 1999” đã mô tả một loạt các cuộc phỏng vấn mà CDC thực hiện với 14 phụ nữ ở California, những người gần đây đã báo cáo phơi nhiễm thai kỳ với Accutane. Các nhà nghiên cứu đã khởi xướng nghiên cứu này để thu hút sự chú ý đến việc phơi nhiễm Accutane thai kỳ và tiếp tục tìm hiểu thêm lý do tại sao những phơi nhiễm thai kỳ này xảy ra.
Nghiên cứu chẩn đoán một số vấn đề góp phần vào phơi nhiễm. Mặc dù tất cả phụ nữ được phỏng vấn đều biết rằng không nên sử dụng Accutane khi mang thai, nhưng không có báo cáo nào quan sát thấy tất cả các thành phần của Chương trình Dự phòng Thai kỳ. 4 phụ nữ đã không nhìn thấy bất kỳ tài liệu giáo dục nào ngoài những gì được in trên bao bì. Hầu hết những phụ nữ được phỏng vấn không sử dụng 2 hình thức kiểm soát sinh sản, 8 người đã không sử dụng biện pháp tránh thai nào. Và chỉ có 10 phụ nữ thực hiện các xét nghiệm thử thai trước khi dùng Accutane. Nghiên cứu nhấn mạnh rằng các bác sĩ tiếp tục bỏ qua nhiều yêu cầu của Chương trình Dự phòng Thai kỳ.
Báo cáo của CDC cũng nhấn mạnh vấn đề lạm dụng. Ít nhất một nửa số người được hỏi báo cáo rằng họ không bị mụn trứng cá nặng, tái phát mà thuốc được chỉ định. Một phụ nữ đã mô tả dùng Accutane 1 tuần mỗi tháng để ngăn da nhờn trong chu kỳ của mình. Một phần, các nhà nghiên cứu đã liên kết việc tăng sử dụng thuốc với quảng cáo. 4 trong số những người được hỏi nói rằng quảng cáo đã góp phần vào quyết định của họ đến gặp bác sĩ.
Trong vòng 2 tháng, Hoffmann-La Roche đã công bố một can thiệp mới, Chương trình Dự phòng Thai kỳ Mục tiêu, sẽ hướng tới 0.27% phụ nữ đã bị bỏ qua trong những nỗ lực trước đó. Chương trình bao gồm một loạt các thay đổi ghi nhãn mới. Ví dụ: 2 lần thử thai nên được sắp xếp theo hướng dẫn và thực hiện trước khi bắt đầu điều trị, bác sĩ nên gọi cho dược sĩ với đơn thuốc (trái ngược với việc giao đơn thuốc bằng văn bản cho bệnh nhân) và 2 phương pháp ngừa thai an toàn và hiệu quả nên được sử dụng. FDA đã phê duyệt nhãn mới vào tháng 5. Roche cũng đã lên kế hoạch phân phối các gói giáo dục cho bệnh nhân có tên là “Be Smart, Be Safe, Be Sure” và tổ chức các lớp Giáo dục Y khoa Liên tục cho các bác sĩ kê đơn. 1 video sẽ được phát cho các bác sĩ để cho bệnh nhân thấy được những rủi ro và Roche sẽ nhắc lại tầm quan trọng của việc tư vấn và xét nghiệm thử thai hàng tháng. Mùa xuân đó, Roche đã phân phối các xét nghiệm thử thai cho tất cả các bác sĩ được biết để kê đơn Accutane. Video giáo dục đã kết thúc vào tháng 6. Và tháng 7, Roche bắt đầu đào tạo các bác sĩ kê đơn.
Ngày 18/9/2000, FDA đã kêu gọi Ủy ban Tư vấn Thuốc Da liễu cho lời khuyên về Accutane. Bác sĩ Jonca Bull của FDA đặt câu hỏi cho Ủy ban. “Từ lập trường quản lý rủi ro, chúng tôi trong nhiệm vụ này có thể đảm bảo sử dụng các sản phẩm thuốc an toàn và hiệu quả, dựa trên thực tế xã hội và điều chỉnh, phát triển một chương trình khung làm giảm thêm nguy cơ gây quái thai đã biết với việc sử dụng (Accutane) hay không?” FDA yêu cầu hội đồng xem xét nên sử dụng công cụ quản lý rủi ro nào cho Accutane và những bước tiếp theo nên được thực hiện, nếu có, nếu việc quản lý rủi ro không được thực hiện. Ủy ban đã phản ánh về một loạt các cơ chế – tăng cường truyền thông rủi ro, gói sửa đổi, phân phối hạn chế, theo dõi bệnh nhân bắt buộc và cải thiện sự đồng ý thông báo – và đưa ra khuyến nghị chung cho FDA.
Hoffmann-La Roche đã trình bày dữ liệu cho Ủy ban, cho thấy giáo dục sẽ là cách tốt nhất để giảm thiểu mang thai. Roche có kiến thức về 1995 trường hợp phơi nhiễm thai kỳ với Accutane, 70% trong số đó xảy ra sau khi bắt đầu Chương trình Dự phòng Thai kỳ. Trong số những phụ nữ đó, ước tính 61% chỉ sử dụng 1 hình thức tránh thai và 34% không sử dụng biện pháp tránh thai nào. 14% phụ nữ đã vô tình mang thai ở lần khám đầu tiên. Điều này phản ánh nhu cầu cần thêm thông tin về tầm quan trọng của nhiều hình thức kiểm soát sinh đẻ và thử thai. Roche cũng đưa ra số liệu cho thấy nhiều bác sĩ đã không tuân thủ Chương trình Dự phòng Thai kỳ, kê đơn mà không thử thai lần đầu hoặc sự đồng ý có chữ ký. Có lẽ, những nỗ lực tiếp cận có thể cải thiện sự tham gia của bác sĩ và mang thai ít hơn.
Ủy ban cũng lắng nghe những thông tin thông thường về sự nguy hiểm của phơi nhiễm Accutane khi mang thai và về loại thuốc có khả năng độc nhất chữa mụn trứng cá. Bác sĩ Lammer, một trong những người tham gia Nghiên cứu năm 1999 của CDC, nhận xét, “Về mặt thuốc, mức độ rủi ro và mức độ nghiêm trọng của dị tật, loại thuốc này thực sự độc đáo.” Bác sĩ Barbara Reed, thành viên của Hội đồng American Academy of Dermatology, đã mô tả các nguy cơ liên quan đến mụn trứng cá: “Không có một căn bệnh nào gây ra nhiều tổn thương tâm lý, sự không hòa hợp giữa cha mẹ và con cái, sự bất an chung và cảm giác tự ti hơn mụn trứng cá.” Đó là trận chiến của những thứ cao nhất.
Đại diện của Celgene, nhà sản xuất Thalidomide tại Hoa Kỳ, đã mô tả chương trình đã được thực hiện với việc phát hành loại thuốc đó năm 1998. Theo Hệ thống Giáo dục Thalidomide và An toàn Kê đơn (System for Thalidomide Education and Prescribing Safety – STEPS), Celgene yêu cầu các bác sĩ và nhà thuốc phải đăng ký với công ty để kê đơn hoặc phân phối thuốc. Ngoài ra, tất cả các bệnh nhân tham gia vào một cuộc khảo sát bắt buộc theo dõi việc sử dụng Thalidomide. Vào thời điểm đó, khoảng 10,500 nhà thuốc và 900 bác sĩ đã đăng ký tham gia chương trình. Mỗi đại diện của Thalidomide Victims Association of Canada, Organization of Teratology Information Services, March of Dimes, và Public Citizen chỉ vào STEPS và yêu cầu Ủy ban yêu cầu Roche thực hiện một chương trình tương tự và hạn chế sử dụng thuốc.
Các bác sĩ chuyên khoa da liễu lên tiếng phản đối các chương trình sử dụng hạn chế. Bác sĩ Reed cho rằng hệ thống sẽ phá vỡ mối quan hệ giữa bác sĩ và bệnh nhân và buộc bệnh nhân phải tìm bác sĩ mới chỉ để bắt đầu một phương pháp điều trị mới. Buộc các bệnh nhân thảo luận về quan hệ tình dục và mang thai với một bác sĩ lạ sẽ làm suy yếu các nỗ lực giáo dục. Bệnh nhân ở các cộng đồng nông thôn có thể phải di chuyển quãng đường dài để có được sự chăm sóc cần thiết. Một bác sĩ khác phàn nàn rằng sự đề xuất đã đi quá sâu vào chuyên môn, “Là một người hành nghề, quyết định của tôi là bệnh nhân này được điều trị bằng Accutane, và đó vẫn sẽ là quyết định của tôi chứ không phải của nhà sản xuất hay dược sĩ, hay bất kỳ ai khác … Tôi tin rằng giáo dục … là cách để thực hiện điều này.”
Ủy ban đã bỏ phiếu cho 1 hình thức sử dụng hạn chế. Ngoài tăng cường nỗ lực giáo dục, như Roche đề xuất, Chương trình Dự phòng Thai kỳ nên được sửa đổi: Tất cả các đơn thuốc nên được giới hạn trong 30 ngày, và trước khi phân phối Accutane, dược sĩ phải xác nhận rằng xét nghiệm thử thai là âm tính. Với phụ nữ dùng thuốc, việc đăng ký Chương trình nên là bắt buộc cũng như nên tham gia khảo sát Slone (Trước đây, việc tham gia khảo sát là tự nguyện và các thành viên Ủy ban lo lắng rằng dữ liệu không chính xác). Ủy ban cũng khuyến nghị Roche nên thực hiện giám sát độc lập để xác định phơi nhiễm thai kỳ.
Trong một bức thư gửi bác sĩ, ngày 9/1/2001, FDA tuyên bố rằng những nỗ lực giáo dục đã không thành công trong việc loại bỏ các trường hợp phơi nhiễm thai kỳ với Accutane. Ủy ban đã khuyến nghị “các biện pháp hệ thống hóa bổ sung để quản lý rủi ro và thông báo đầy đủ cho bệnh nhân.” FDA tuyên bố rằng họ đang hợp tác chặt chẽ với Roche để giải quyết các khuyến nghị được đưa ra bởi ủy ban tư vấn.
9 tháng sau, tháng 10/2001, FDA đã tiết lộ SMART (Hệ thống Quản lý Độc tính gây quái thai Liên quan Accutane – System to Manage Accutane Related Teratogenicity). Chương trình mới có hiệu lực ngày 10/4/2002 sẽ yêu cầu các bác sĩ kê đơn nghiên cứu SMART “Hướng dẫn Thực hành Tốt nhất” do Roche cung cấp và sau đó gửi “Letter of Understanding” có chữ ký của họ đến công ty xác nhận kiến thức về cách ngăn ngừa phơi nhiễm ở thai nhi. Khi nhận được thư, Roche sẽ gửi cho người kê đơn nhãn dán đủ tư cách màu vàng. Tất cả các đơn thuốc Accutane nên được đính kèm một nhãn dán màu vàng đặc biệt, cho biết bệnh nhân đã thử thai âm tính và được tư vấn về phòng ngừa mang thai. Thử thai sẽ được lặp lại mỗi tháng trước khi cung cấp đơn thuốc mới. Dược sĩ sẽ chỉ được phép điền vào đơn thuốc có nhãn dán màu vàng. Ngoài ra, tất cả bệnh nhân nữ phải có cơ hội tham gia khảo sát Slone. Việc tham gia sẽ không bắt buộc.
Vẫn còn phải xem liệu SMART sẽ hoàn thành mục tiêu loại bỏ thảm kịch những đứa trẻ phơi nhiễm Accutane hay không. Rõ ràng, chương trình này được thiết kế như một sự thỏa hiệp giữa mong muốn các chương trình mang phong cách châu Âu đạt tỷ lệ phơi nhiễm thai kỳ rất thấp bằng cách hạn chế sử dụng và mục tiêu mâu thuẫn là dễ dàng sử dụng thuốc cho những người cần nó. Mặc dù chương trình có thể giống như một hình thức sử dụng hạn chế, chỉ có các bác sĩ với nhãn dán màu vàng đặc biệt mới có thể kê đơn. Bất kỳ bác sĩ nào cũng có thể gửi Letter of Understanding và nhận được nhãn dán. Trình độ chuyên môn không giới hạn ở các bác sĩ da liễu hoặc các nhà cung cấp chăm sóc sức khỏe khác với đào tạo đặc biệt. Và giống như Letter of Understanding, bản thân nhãn dán không có gì khác hơn là tuyên bố của một bác sĩ tự chứng nhận. Cái thiếu rõ rệt ở SMART là bất kỳ can thiệp nào được thiết kế để giải quyết vấn đề lạm dụng. Nhãn dán màu vàng biểu thị rằng bệnh nhân đã được nhận các xét nghiệm thử thai và tư vấn, chứ không phải họ bị mụn nặng. Rõ ràng, SMART đáp ứng mối quan tâm của các bác sĩ da liễu tại cuộc họp tháng 9/2000: Liệu bệnh nhân nhận đơn thuốc Accutane vẫn nằm trong sự kiểm soát của bác sĩ hay không?
Với một người, Roche có thể đã biến lớp giáo dục y tế liên tục nửa ngày của mình thành điều kiện tiên quyết bắt buộc để chứng nhận thay vì một sự kiện được đề xuất. Bằng cách đó, công ty đảm bảo rằng các bác sĩ nhận nhãn dán thực sự đã được thông báo về các thực hành tốt nhất. Tương tự, FDA có thể đã làm theo khuyến nghị của Ủy ban và yêu cầu tài liệu thực về 2 lần thử thai âm tính – thay vì chỉ là 1 nhãn dán màu vàng. Sau đó, bác sĩ sẽ không thể kê đơn thuốc nếu quên thử thai. Để viết đơn thuốc mà không thực hiện 2 xét nghiệm, bác sĩ sẽ phải chủ động giả mạo tài liệu. Ít nhất, FDA đã quy định chẩn đoán mụn trứng cá nặng, tái phát là một trong những điều kiện tiên quyết để sử dụng nhãn dán màu vàng, điều này sẽ gửi một thông điệp rõ ràng rằng Accutane không phù hợp cho sử dụng ngoài nhãn.
Điều đó nói lên rằng, SMART rõ ràng cung cấp một số giá trị gia tăng cho hệ thống hiện có. Có lẽ, nhiều bác sĩ sẽ thực sự đọc Hướng dẫn Thực hành Tốt nhất và được hưởng lợi từ tăng cường giáo dục. Ngoài ra, các nhãn dán màu vàng có thể đóng vai trò như một lời nhắc nhở các bác sĩ thực hiện các xét nghiệm thử thai và tư vấn. Tổng hợp các nhãn dán màu vàng và thư chứng nhận có thể được hiểu là một hợp đồng, và các bác sĩ sử dụng nhãn dán mà không có sự bảo vệ cần thiết có thể phải chịu trách nhiệm cho hành động của mình. Hoặc có lẽ các nhãn dán màu vàng sẽ tạo cơ sở cho trách nhiệm pháp lý sai sót trong hành nghề. Các biện pháp phòng ngừa được biểu thị bằng nhãn dán cho thấy một tiêu chuẩn chăm sóc rõ ràng cần thiết cho chuyên môn nghề nghiệp. Tổng quát hơn, thực tế của một chương trình mới lạ như vậy chắc chắn sẽ truyền tải thông điệp rằng Accutane gây ra rủi ro nghiêm trọng và không nên được kê đơn một cách ngẫu nhiên.
Accutane liên quan đến tự tử?

Trọng tâm chính của tương lai về quy định của Accutane có thể là bệnh tâm thần. Kể từ ngày 31/12/2001, 140 người dùng Accutane trên toàn thế giới (94 ở Hoa Kỳ) đã tự sát khi dùng Accutane hoặc vài tháng sau khi ngừng điều trị. 257 bệnh nhân khác đã phải nhập viện vì trầm cảm nặng hoặc cố tự tử. Nhiều báo cáo rằng các triệu chứng giảm dần hoặc biến mất sau khi ngừng điều trị bằng Accutane. Một số bệnh nhân nhận thấy rằng khi họ tiếp tục dùng thuốc, trầm cảm lại trở lại. Accutane được xếp hạng top 10 loại thuốc hàng đầu trong cơ sở dữ liệu của FDA về các báo cáo trầm cảm và tự tử. Nhưng số trường hợp được báo cáo trong số những người dùng Accutane thực sự không nhiều hơn quần thể chung. Khoảng 6.1% người trong độ tuổi 15-24 có triệu chứng trầm cảm nặng trong bất kỳ tháng nào. Và thanh thiếu niên và người trẻ bị mụn trứng cá nặng có thể đặc biệt dễ bị trầm cảm. Điều này gây ra 1 tình huống khó hiểu: FDA đã thu thập các báo cáo về những bệnh nhân dường như bị trầm cảm chỉ khi dùng Accutane, nhưng tỷ lệ trầm cảm không tăng trong toàn bộ quần thể người dùng.
Có lẽ vì đã có kinh nghiệm trước đây, FDA đã nhanh chóng yêu cầu Hoffmann-La Roche cảnh báo khả năng trầm cảm và tự tử, ngay cả khi không có bằng chứng rõ ràng. Tháng 6/1985, khi FDA yêu cầu cảnh báo hộp đen cho Accutane, trầm cảm được đưa vào như một trong những tác dụng phụ có thể xảy ra. Năm 1997, dựa trên các báo cáo rối loạn tâm thần nghiêm trọng, FDA đã yêu cầu Hoffmann-La Roche nâng cao cảnh báo. Ngày 24/2/1998, Roche đã phát hành nhãn mới.
1 tháng sau, Vương quốc Anh yêu cầu một cảnh báo tương tự.
Tháng 3/2001, Hoffmann-La Roche đã xuất bản một hướng dẫn về thuốc giải thích mối liên quan có thể có giữa tự tử và Accutane cho bệnh nhân. Công ty cũng yêu cầu bệnh nhân phải thông báo cho bác sĩ bất kỳ tiền sử bệnh tâm thần nào. Các bác sĩ cần kiểm tra dấu hiệu trầm cảm hàng tháng. Công ty cũng gửi tài liệu mới cho các bác sĩ da liễu và bác sĩ kê đơn khác hướng dẫn họ cách nhận biết các dấu hiệu trầm cảm sớm.
Tháng 7/1998, 14 tháng sau khi FDA lần đầu tiên yêu cầu Hoffmann-La Roche thêm tự tử vào nhãn cảnh báo, cơ quan này đã phát hiện ra rằng 1 nghiên cứu ở Pháp từ năm 1994 cho thấy mối liên hệ giữa Accutane và trầm cảm. Tháng 3/1997, Roche đã thêm “nỗ lực tự tử” vào nhãn cảnh báo của Accutane bán cho Pháp. Hoffmann-La Roche chưa bao giờ chia sẻ thông tin này với FDA.
Ngoài ra, Roche cũng thể hiện sự vô cảm với mối lo tự tử. Năm 1998, cùng thời gian mà FDA yêu cầu nguy cơ tự tử xuất hiện trên nhãn, Roche đã phát hành một quảng cáo mới cho Accutane gồm tuyên bố sau: “Điều trị hiệu quả với mụn trứng cá tái phát nghiêm trọng, giúp giảm thiểu sẹo tiến triển, cũng như các tác động tâm lý xã hội tiêu cực như trầm cảm và sự tự nhận thức bản thân kém.” Ngày 5/3/1998, FDA đã gửi thư cảnh báo công ty yêu cầu rút quảng cáo. Theo cơ quan này, “Các tuyên bố trong các tài liệu quảng cáo của Roche, rằng liệu pháp Accutane sẽ giảm thiểu hoặc cải thiện tình trạng tâm lý bệnh nhân, bao gồm trầm cảm, là sai hoặc gây hiểu lầm và thúc đẩy việc sử dụng không được chấp thuận.”
Và giống như dị tật bẩm sinh do Accutane gây ra, các trường hợp tự tử và trầm cảm đã tạo ra những kẻ thù mới cho Hoffmann-La Roche. Một trong số đó là tổ chức quốc tế “Roaccutane/Accutane Action Group,” thành lập tháng 1/1999.
Một đồng minh của nhóm là Nghị sĩ Michigan Bart Stupak. Ngày 14/5/2000, con trai 17 tuổi của Stupak là B.J. đã tự bắn mình đến chết. B.J. đã sử dụng Accutane và vài tuần sau khi chết, Stupaks đã phát hiện ra mối liên quan của thuốc với trầm cảm. Kể từ đó, Bart Stupak đã làm việc chăm chỉ để công khai những gì ông gọi là “những vụ tự tử tự nhiên”, những vụ tự tử ở những người có vẻ hạnh phúc khi sử dụng Accutane. Không lâu sau cái chết của B.J., Stupak đã kể câu chuyện của mình trên chương trình “Today Show” của NBC. Ngoài ra, Stupak đã sử dụng vị trí chính trị của mình để gây áp lực với FDA và Hoffmann-La Roche để tăng quy định về thuốc. Chính Stupak đã thúc đẩy công ty tạo 1 mẫu đơn đồng ý và hướng dẫn dùng thuốc cho bệnh nhân. Sự thúc đẩy Hoffmann-La Roche của Stupak cũng chấm dứt quảng cáo nhắm vào trẻ vị thành niên.
Trường hợp của Stupak đã đưa Accutane vào chương trình nghị sự Quốc hội. Ngày 5/12/2000, Ủy ban Cải cách Hạ viện đã tổ chức một cuộc họp, “Thuốc trị mụn Accutane và nó bị cho là liên quan đến trầm cảm và tự tử.” Ủy ban đã lắng nghe lời khai từ cha mẹ của những thanh thiếu niên đã tự tử khi đang dùng Accutane. Đại diện của FDA, Hoffmann-La Roche và American Academy of Dermatology cũng tham gia. Một phiên điều trần đã được lên kế hoạch tháng 10/2001 để xem Hoffmann-La Roche và FDA có đưa ra cho người tiêu dùng những cảnh báo đầy đủ về việc tự tử hay không. Quốc hội hoãn phiên điều trần sau ngày 11/9.
Nhưng sau ngày 11/9, một trường hợp cụ thể đã đưa mối liên quan giữa Accutane và tự tử trở lại. Ngày 5/1/2002, Charles Bishop, 15 tuổi, đã lái một chiếc máy bay nhỏ đam vào một tòa nhà văn phòng ở Tampa, Florida. Các nhà điều tra đã sớm phát hiện ra một đơn thuốc Accutane trong số đồ dùng cá nhân của Bishop. Các xét nghiệm độc tính không tìm thấy Accutane trong máu, nhưng mẹ anh ta báo cáo rằng Charles đã uống thuốc. Bà Bishop cho rằng Accutane có thể phải chịu trách nhiệm cho hành vi của con trai mình. Báo chí cả nước đưa tin về mối liên quan giữa Accutane và tự sát.
Theo một nhà phân tích trích dẫn trong New Jersey Record, doanh số của Accutane đã giảm 10% kể từ năm 2000 do sự công khai của các vụ tự tử liên quan đến Accutane. Không còn nghi ngờ gì nữa, mối liên quan giữa Accutane và trầm cảm sẽ tiếp tục gây ra vấn đề cho Hoffmann-La Roche. Nhà sản xuất và FDA tiếp tục đấu tranh với hiện tượng công khai nhưng chưa được hiểu rõ này.
Dược lực học
Sinh lý bệnh mụn trứng cá
Sinh lý bệnh của mụn trứng cá rất phức tạp, gồm nhiều yếu tố và có liên quan đến nhiều quá trình viêm tiềm ẩn. 4 quá trình sinh lý bệnh chính có liên quan đến sự hình thành mụn trứng cá là: 1) tăng sản tuyến bã nhờn và sản xuất bã nhờn quá mức, 2) tróc vảy biểu mô nang bất thường, 3) tăng sinh Propionibacterium acnes với một loạt các hiệu ứng tiền viêm trực tiếp hoặc gián tiếp và 4) viêm tiền lâm sàng (cận lâm sàng) có thể nhìn thấy. Không giống như các phương pháp điều trị mụn khác, Isotretinoin chống lại cả 4 yếu tố sinh lý bệnh này và đã được chứng minh là có tác dụng ức chế bã nhờn, làm tan nhân mụn, chống viêm và có thể có tác dụng miễn dịch liên quan đến liệu pháp trị mụn. Mặc dù các cơ chế của Isotretinoin mang lại sự thuyên giảm kéo dài vẫn chưa hoàn toàn được hiểu rõ, việc giảm đáng kể hoạt động và kích thước tuyến bã nhờn cùng thay đổi vi khí hậu không có lợi cho sự tăng sinh của P.acnes do ức chế bã nhờn kéo dài và giảm biểu hiện toll-like receptor-2 (TLR2) trên các tế bào đơn nhân lưu hành kéo dài trong vài tháng sau điều trị đã được đề xuất. Điều này rất thú vị vì nó cho thấy lợi ích điều trị bằng Isotretinoin trong mụn trứng cá liên quan đến cơ chế hoạt động toàn thân hơn là chỉ có tác dụng ức chế bã nhờn hạn chế ở da. Điều này được hỗ trợ thêm bởi quan sát rằng thời gian thuyên giảm tương quan với việc đạt đến ngưỡng phạm vi phơi nhiễm tích lũy dựa trên liều hàng ngày/kg.
Cơ chế tác dụng và tác dụng trong điều trị mụn trứng cá
Isotretinoin là liệu pháp duy nhất tác động đến tất cả các căn nguyên chính liên quan đến mụn trứng cá. Nó đạt được hiệu quả đáng chú ý này bằng cách ảnh hưởng đến sự tiến triển của chu kỳ tế bào, sự biệt hóa tế bào, sự sống tế bào và quá trình apoptosis (chết tế bào theo chương trình). Nó làm giảm đáng kể sản xuất bã nhờn, ảnh hưởng đến sự phát sinh nhân mụn, làm giảm P.acnes trên bề mặt và trong ống dẫn, và có đặc tính chống viêm. Liều 0.5-1.0 mg/kg/ngày giảm nhanh sự bài tiết bã nhờn 90% trong vòng 6 tuần. Không giống như tretinoin (all-trans-retinoic acid), Isotretinoin có rất ít hoặc không có khả năng liên kết với các protein gắn retinol hoặc các receptors nhân retinoic acid (RARs and RXRs) nhưng có thể hoạt động như một tiền thuốc được chuyển hóa nội bào thành các chất chuyển hóa là chất chủ vận cho các receptors nhân RAR và RXR.
Isotretinoin có ít nhất 5 chất chuyển hóa quan trọng về mặt sinh học: 13-cis-4-oxo-retinoic acid (4-oxo-isotretinoin), all-trans-retinoic acid (tretinoin), all-trans-4-oxo-retinoic acid (4-oxo-tretinoin), 9-cis-retinoic acid và 9-cis-4-oxo-retinoic acid. Các nghiên cứu kiểm tra tỷ lệ bài tiết bã nhờn ở những bệnh nhân bị mụn trứng cá nghiêm trọng đã chỉ ra rằng, trong vòng 4 tuần, 4-oxo-isotretinoin (uống 30-60 mg/ngày) chỉ giảm 70% so với cùng một liều Isotretinoin uống trong 4 tuần. Isotretinoin cũng vượt trội so với 9-cis-retinoic acid và all-trans-retinoic acid về khả năng ức chế bã nhờn. Chỉ tretinoin và 4-oxo-tretinoin liên kết với RAR-γ, đây là thụ thể được cho là quan trọng trong điều trị mụn trứng cá bằng retinoid. Nồng độ tretinoin nội bào cao hơn đáng kể so với Isotretinoin. Các dữ liệu cho thấy tretinoin có thể là dạng hoạt động nội bào của Isotretinoin và khiến Tsukada và các cộng sự kết luận rằng Isotretinoin nên được coi là một tiền thuốc. Do đó, sự khác biệt về nồng độ trong huyết tương của các chất chuyển hóa này có thể giải thích sự khác biệt về cường độ đáp ứng điều trị và mức độ nghiêm trọng và/hoặc sự xuất hiện của các tác dụng phụ trên từng bệnh nhân. Một nghiên cứu gần đây đã chứng minh rằng Isotretinoin gây ra apoptosis trong tế bào tiết bã nhờn và những tác động này độc lập với hoạt hóa thụ thể RAR, cho thấy rằng Isotretinoin đường uống làm teo tuyến nhờn và dẫn đến giảm sản xuất bã nhờn.
Isotretinoin làm giảm đáng kể quá trình phát sinh mụn bằng cách giảm sự tăng sừng hóa. Cơ chế chính xác vẫn chưa chắc chắn, không có bằng chứng nào cho thấy Isotretinoin ảnh hưởng đến hoạt động trao đổi chất của tế bào sừng.
Isotretinoin đường uống không có tác dụng kháng khuẩn trực tiếp, nhưng bằng cách giảm nhanh lưới nội chất trơn và kích thước của ống bã nhờn, nó làm thay đổi vi môi trường trong ống ít thuận lợi hơn cho vi khuẩn P.acnes. Kết quả là làm giảm 3 log P.acnes, một sự ức chế lớn hơn nhiều so với dùng kháng sinh đường uống và bôi tại chỗ. Người ta cũng đề xuất rằng giống như all-trans-retinoic acid, Isotretinoin có thể làm tăng cơ chế bảo vệ vật chủ và điều chỉnh hóa ứng động các tế bào monocyte, một phần giải thích tác dụng chống viêm của thuốc. Sự giảm đáng kể quần thể P.acnes cũng góp phần làm giảm viêm trong mụn trứng cá.
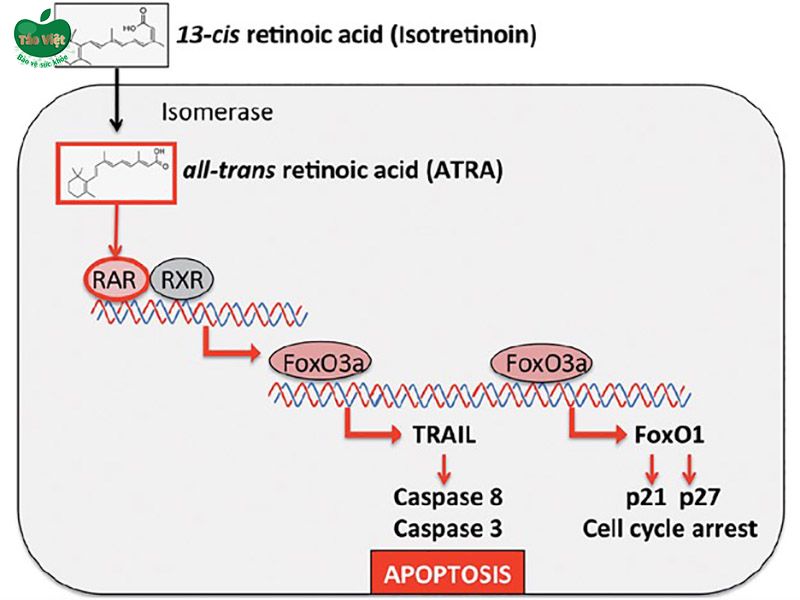
Cơ chế tác dụng không mong muốn trên tâm thần
RARs có trong não và các mô phôi thai ở vùng sọ, tim và tuyến ức. Giống như thụ thể glucocorticoid và hormone tuyến giáp, RARs là một phần của siêu họ thụ thể nhân điều chỉnh sự biểu hiện gen trong não. Đáng chú ý, các RARs quy định biểu hiện của homeobox, hay HOX, các gen từ đó kiểm soát chương trình phát triển ở các loài khác nhau. Ngoài tác dụng trước khi sinh, Isotretinoin có thể ảnh hưởng đến nhận thức trong cuộc sống trưởng thành. RARs được biểu hiện ở hồi hải mã, vùng đồi thị và cầu não (RARα) và thể vân, vùng dưới đồi và tủy sống (RARβ), và retinoic acid đã được tìm thấy điều chỉnh độ dẻo dai của synap và sự phát triển thần kinh ở tuổi trưởng thành.
Có 1 giả thuyết rằng Isotretinoin gây ra các hành vi liên quan đến trầm cảm bằng cách giảm sự phát triển thần kinh ở người trưởng thành hoặc thay đổi biểu hiện các thành phần của hệ thống dẫn truyền thần kinh serotonergic, dẫn đến suy giảm tín hiệu serotonin. Một mối liên quan giữa tín hiệu retinoic acid với stress và trầm cảm được hỗ trợ bởi sự chồng chéo giữa các vùng não liên quan đến cả hai. Hơn nữa, hình ảnh não chức năng đã cho thấy sự giảm chuyển hóa não ở vỏ não trước trán – 1 khu vực được thiết lập làm trung gian cho các triệu chứng trầm cảm – ở bệnh nhân được điều trị mụn bằng Isotretinoin.
Các yếu tố phiên mã Forkhead box nhóm O có thể liên quan đến cả tác dụng điều trị và tác dụng phụ của Isotretinoin. Điều hòa lên Forkhead box protein O1 có thể ức chế sự phát triển thần kinh của hồi hải mã.
Thử nghiệm lâm sàng
Một thử nghiệm so sánh ngẫu nhiên về 2 chế độ điều trị bằng Isotretinoin đường uống liều thấp trong mụn trứng cá từ vừa đến nặng.
Isotretinoin đường uống có hiệu quả cao trong tất cả các dạng và cấp độ của mụn trứng cá, ngay cả ở liều thấp hơn (< 0.5 mg/kg/ngày). Có rất ít dữ liệu so sánh về các chế độ điều trị liều thấp khác nhau của Isotretinoin đường uống.
Mục tiêu: Đánh giá và so sánh hiệu lực và khả năng dung nạp của 2 chế độ điều trị bằng Isotretinoin đường uống liều thấp (20 mg mỗi ngày và 20 mg cách 1 ngày) trong điều trị mụn trứng cá từ trung bình đến nặng.
Phương pháp: Tổng cộng 240 bệnh nhân bị mụn trứng cá từ vừa đến nặng đã được chọn và phân ngẫu nhiên thành 2 nhóm và được điều trị với liều cố định 20 mg Isotretinoin (Nhóm A – hàng ngày và Nhóm B – cách 1 ngày) trong 24 tuần và theo dõi trong 12 tuần sau trị liệu.
Kết quả: Tổng cộng có 234 bệnh nhân hoàn thành nghiên cứu. Khi kết thúc trị liệu, giảm tổng số mụn từ ban đầu lên tới 98.99% (Nhóm A) và 97.69% (Nhóm B) (P < 0.01), đáp ứng tuyệt vời đã được quan sát thấy ở 98.3% (Nhóm A) và 93.96% (Nhóm B) bệnh nhân (P = 0.166). Trong trường hợp mụn trứng cá nghiêm trọng, Nhóm A thực hiện tốt hơn đáng kể so với Nhóm B cho đến hết 36 tuần. Trong khi ở mụn trứng cá vừa phải, sự khác biệt đáng kể trong đáp ứng giữa 2 nhóm được quan sát chỉ trong tối đa 12 tuần. Không quan sát thấy tác dụng phụ nghiêm trọng.
Kết luận: Cả 2 chế độ điều trị bằng Isotretinoin đều được dung nạp tốt và được coi là phương pháp điều trị hiệu quả với mụn trứng cá từ vừa đến nặng. Tuy nhiên, trong chế độ trị mụn vừa phải, liều 20 mg cách 1 ngày có thể được ưu tiên hơn. Chế độ 20 mg mỗi ngày là lựa chọn tốt hơn cho mụn trứng cá nghiêm trọng về mặt đáp ứng.
Dược động học
Hấp thu: Sinh khả dụng (F) của thuốc thấp. Thời gian đạt nồng độ đỉnh trong huyết tương (Tmax) là 3.2 giờ khi đói và 5.3 giờ khi đã ăn. Nồng độ đỉnh trong huyết tương (Cmax) là 301 ng/mL khi đói và 862 ng/mL khi đã ăn. Diện tích dưới đường cong (AUC) là 3703 ng.h/mL khi đói và 10,004 ng.h/mL khi đã ăn.
Phân bố: Tỷ lệ liên kết với protein huyết tương là 99.9%. Thuốc liên kết chủ yếu với albumin.
Chuyển hóa: Thuốc được oxy hóa ở gan thông qua hệ enzyme gan gồm các isozyme CYP2B6, CYP2C8/9 và CYP3A4. Các chất chuyển hóa là 13-cis-4-oxo-retinoic acid (4-oxo-isotretinoin), all-trans-retinoic acid (tretinoin), all-trans-4-oxo-retinoic acid (4-oxo-tretinoin), 9-cis-retinoic acid và 9-cis-4-oxo-retinoic acid.
Thải trừ: Thời gian bán hủy (t1/2) là 10-20 giờ.
Chỉ định

Mụn trứng cá nghiêm trọng, kháng thuốc, có cục, không đáp ứng với liệu pháp thông thường, bao gồm cả kháng sinh toàn thân.
Chỉ định mồ côi: Bệnh vảy cá ở trẻ em.
Chỉ định chưa được FDA chấp thuận.
Mụn trứng cá vừa phải, u lympho tế bào T ở da, u nguyên bào thần kinh và phòng ngừa ung thư biểu mô tế bào vảy ở bệnh nhân có nguy cơ cao.
Các bác sĩ cùng đã sử dụng Isotretinoin để điều trị rosacea (đỏ ửng da), viêm nang lông và mủ da mặt.
Cách dùng – Liều dùng
Cách dùng
Bệnh nhân có thể hấp thu tối đa Isotretinoin bằng cách dùng thuốc cùng bữa ăn. Nên uống Isotretinoin với một ly nước đầy để tránh kích ứng thực quản.
Liều dùng
Liều khởi đầu của Isotretinoin thường ở mức 0.5 mg/kg/ngày, sau đó tăng dần liều đến 1.0 mg/kg/ngày tùy theo dung nạp của bệnh nhân. Liều có thể lên tới 2.0 mg/kg/ngày (khi dung nạp) nếu bệnh rất nặng.
Một đợt điều trị chuẩn đòi hỏi 15-20 tuần sử dụng Isotretinoin hàng ngày để bệnh thuyên giảm hoàn toàn.
Nếu tổng số nốt giảm > 70% trước khi hoàn thành 15-20 tuần, có thể ngừng thuốc.
Chỉ dùng cho người trưởng thành và trẻ em từ 12 tuổi trở lên.
Tác dụng không mong muốn

Viêm môi hoặc khô môi là tác dụng không mong muốn phụ thuộc liều phổ biến nhất, thấy ở khoảng 90% bệnh nhân dùng Isotretinoin. Khô da, khô miệng, khô mũi và nhạy cảm với ánh nắng mặt trời cũng là những tác dụng phụ rất phổ biến hay gặp ở bệnh nhân dùng Isotretinoin. Cần giáo dục bệnh nhân chống nắng, dưỡng ẩm da và dùng đồ che chắn trước khi bắt đầu dùng thuốc. Bệnh nhân cũng nên tránh mọi thủ tục tái tạo bề mặt da (tẩy lông, mài mòn da, trị liệu bằng laser) trong quá trình điều trị và ít nhất 6 tháng sau điều trị để ngăn ngừa kích ứng da và sẹo.
Tăng triglyceride máu và tăng tốc độ máu lắng cũng là tác dụng phụ rất phổ biến của liệu pháp Isotretinoin. Giám sát xét nghiệm thường xuyên được chỉ định trong giai đoạn cảm ứng và trong suốt quá trình điều trị bằng Isotretinoin để theo dõi các tác dụng phụ thường gặp này.
Các tác dụng bất lợi tiềm tàng khác
Ngứa, kích ứng, tóc mỏng, da mỏng manh, khô mắt, nhiễm trùng da, phát ban, đau xương hoặc khớp, đau cơ. Đau lưng và khớp là phổ biến nhất trong quần thể nhi.
Các bất thường xét nghiệm tiềm tàng khác
Giảm lipoprotein tỷ trọng cao (HDLs), tăng xét nghiệm chức năng gan (LFTs), tăng creatine phosphokinase (CPK), giảm hemoglobin và hematocrit, giảm số lượng hồng cầu và bạch cầu, tăng tiểu cầu. Trong trường hợp hiếm gặp là giảm bạch cầu trung tính hoặc mất bạch cầu hạt, nên ngừng dùng Isotretinoin.
Đã có những mối liên quan gây tranh cãi về Isotretinoin ở những bệnh nhân bị viêm ruột hoặc trầm cảm. Tuy nhiên, các phân tích tổng hợp gần đây đã không cho thấy mối liên quan giữa Isotretinoin và các bệnh này.
Phản ứng da nghiêm trọng, bao gồm hội chứng Stevens-Johnson và hoại tử thượng bì nhiễm độc, đã được báo cáo và đảm bảo ngừng ngay lập tức Isotretinoin nếu chúng xảy ra trong khi điều trị.
Cũng có báo cáo về viêm tụy cấp ở bệnh nhân dùng Isotretinoin với cả nồng độ triglyceride huyết thanh bình thường và tăng cao. Nên ngừng Isotretinoin nếu có triệu chứng viêm tụy.
Lưu ý và thận trọng khi sử dụng thuốc
Bệnh nhân đang điều trị bằng Isotretinoin nên tránh hiến máu khi đang điều trị và khoảng 1 tháng sau khi ngừng điều trị để tránh độc tính trên phôi thai có thể xảy ra nếu chẳng may truyền máu cho phụ nữ có thai.
Cũng có báo cáo tồn tại các giai đoạn trầm cảm và rối loạn tâm thần ở bệnh nhân dùng Isotretinoin. Mặc dù mối tương quan này còn gây tranh cãi, việc sàng lọc các bệnh nhân trầm cảm, có ý định tự tử, cố gắng tự tử trong quá khứ và có các hành vi hung hăng và/hoặc bạo lực nên diễn ra trước khi kê đơn Isotretinoin.
Pseudotumor cerebri (tăng áp lực nội sọ lành tính) đã được trình bày trong trường hợp bệnh nhân dùng Isotretinoin đồng thời với các tetracyclines. Vì lý do này, các tetracyclines không nên dùng cùng với Isotretinoin. Nếu bệnh nhân phát triển các dấu hiệu hoặc triệu chứng của pseudotumor cerebri, việc ngừng dùng Isotretinoin nhanh chóng là cần thiết, và bệnh nhân nên đến khám bác sĩ thần kinh để được đánh giá thêm.
Cảnh báo hộp đen
Isotretinoin là thuốc có phân loại nguy cơ thai kỳ là X theo hệ thống phân loại của FDA trước đây và chống chỉ định ở những phụ nữ đang mang thai hoặc có thể mang thai. Đã có những dị tật bẩm sinh nghiêm trọng được ghi nhận khi phụ nữ mang thai dùng Isotretinoin. Để kê đơn và nhận Isotretinoin, FDA yêu cầu người kê đơn và bệnh nhân phải đăng ký chương trình iPLEDGE. iPLEDGE đảm bảo đáp ứng các yêu cầu phù hợp trước khi phân phối Isotretinoin để ngăn ngừa việc sử dụng thuốc này trong thai kỳ. Những yêu cầu này bao gồm thử thai âm tính và kiêng khem được ghi nhận hoặc sử dụng biện pháp tránh thai trước và trong khi dùng Isotretinoin.
Giám sát
Phụ nữ có khả năng mang thai (FCBP)
2 lần thử thai âm tính là cần thiết trước khi bắt đầu điều trị bằng Isotretinoin. Lần thử thai đầu tiên xảy ra tối đa 30 ngày trước khi bắt đầu dùng thuốc. Lần thử thai thứ hai phải diễn ra ít nhất 19 ngày sau lần thử thai âm tính đầu tiên và trong vòng 5 ngày đầu tiên của chu kỳ kinh nguyệt. Mỗi tháng tiếp theo, bệnh nhân phải có kết quả thử thai âm tính để tiếp tục được điều trị. Sau khi ngừng điều trị, lần thử thai cuối cùng sẽ diễn ra vào 30 ngày sau khi hoàn thành điều trị.
FCBP phải có 2 hình thức tránh thai hiệu quả hoặc kiêng khem hoàn toàn trong thời gian điều trị. Chương trình iPLEDGE định nghĩa kiêng khem là không quan hệ tình dục với bất kỳ nam giới nào 24 giờ/ngày, 7 ngày/tuần. Chương trình iPLEDGE không khuyến cáo kiêng khem như một cách tránh thai trong khi dùng Isotretinoin. Nếu bệnh nhân chọn biện pháp tránh thai, một trong những phương pháp ngừa thai phải là “hình thức chính” của người dùng, bao gồm thắt vòi trứng, thắt ống dẫn tinh, vòng tránh thai hoặc nội tiết tố (thuốc tránh thai kết hợp, miếng dán qua da, cấy dưới da hoặc vòng âm đạo). Các hình thức thứ cấp bao gồm bao cao su nam, màng ngăn, nắp cổ tử cung hoặc xốp đệm tránh thai, tất cả đều sử dụng cùng chất diệt tinh trùng. Kế hoạch hóa gia đình tự nhiên, thuốc tránh thai không có estrogen, bao cao su nữ và lá chắn cổ tử cung là những hình thức tránh thai không được chấp nhận theo chương trình iPLEDGE.
Giám sát trước điều trị (Tất cả bệnh nhân)
LFTs, lipid lúc đói (bao gồm triglyceride), glucose máu, CPK và công thức máu toàn phần (CBC) nên được ghi lại khi có bất kỳ thay đổi nào. Sàng lọc sự thay đổi tâm trạng, rối loạn tâm thần, hung hăng, ý định tự tử, thay đổi da và thay đổi thị giác cũng nên diễn ra trước khi bắt đầu trị liệu.
Giám sát trong khi điều trị (Tất cả bệnh nhân)
LFTs và lipid máu nên được theo dõi trong khoảng thời gian 2 tuần 1 lần cho đến khi thiết lập đáp ứng với Isotretinoin.
Phụ nữ có thai: Chống chỉ định do thuốc gây dị tật bẩm sinh nghiêm trọng.
Phụ nữ đang cho con bú: Không nên cho con bú trong khi điều trị và ít nhất 8 ngày sau khi ngừng điều trị.
Tương tác thuốc
Phối hợp với Aminolevulinic acid (đường uống hoặc tại chỗ) và Methyl aminolevulinate: Hiệp đồng dược lực học làm tăng độc tính của thuốc. Tránh hoặc sử dụng thuốc thay thế. Tránh dùng các thuốc quang độc tính khác với aminolevulinic acid đường uống trong 24 giờ trong suốt thời gian phẫu thuật.
Phối hợp với các tetracyclines (Demeclocycline, Doxycycline, Minocycline, Omadacycline, Oxytetracycline, Sarecycline và tetracycline): Có thể gây ra pseudotumor cerebri. Cơ chế không rõ. Tránh hoặc sử dụng thuốc thay thế.
Phối hợp với Palifermin: Làm tăng độc tính của Isotretinoin. Tránh hoặc sử dụng thuốc thay thế.
Chống chỉ định
Quá mẫn cảm với Isotretinoin, vitamin A hoặc bất cứ thành phần nào của thuốc.
Phụ nữ có thai hoặc có thể có thai.
Một số chế phẩm trên thị trường – Giá bán
Accutane

Nhà sản xuất: Roche.
Các dạng hàm lượng: 10, 20 và 40 mg.
Absorica

Nhà sản xuất: Ranbaxy Laboratories.
Các dạng hàm lượng: 10, 20, 25, 30, 35 và 40 mg.
Amnesteem

Nhà sản xuất: Mylan.
Các dạng hàm lượng: 10, 20 và 40 mg.
Claravis

Nhà sản xuất: TEVA.
Các dạng hàm lượng: 10, 20, 30 và 40 mg.
Myorisan

Nhà sản xuất: AKORN.
Các dạng hàm lượng: 10, 20 và 40 mg.
Zenatane

Nhà sản xuất: Dr. Reddy’s Laboratories.
Các dạng hàm lượng: 10, 20, 30 và 40 mg.
Oratane

Nhà sản xuất: Swiss Caps AG.
Các dạng bào chế: 5, 10, 20, 30 và 40 mg.
Giá bán (tính theo viên): 12,840 VNĐ/viên Oratane 10 mg.
19,260 VNĐ/viên Oratane 20 mg.
Tài liệu tham khảo:
James J. Leyden, MD, FAAD, James Q. Del Rosso, DO, FAOCD, and Eric W. Baum, MD, MSc, The Use of Isotretinoin in the Treatment of Acne Vulgaris, Clinical Considerations and Future Directions, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3970835/
Alison Layton, The use of isotretinoin in acne,
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2835909/
Alessandra Suuberg, JD, Psychiatric and Developmental Effects of Isotretinoin (Retinoid) Treatment for Acne Vulgaris,
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6383167/
Hannah D. Pile; Nazia M. Sadiq, Isotretinoin,
https://www.ncbi.nlm.nih.gov/books/NBK525949/
Daulat Ram Dhaked, Ram Singh Meena, Anshul Maheshwari, Uma Shankar Agarwal, and Saroj Purohit, A randomized comparative trial of two low-dose oral isotretinoin regimens in moderate to severe acne vulgaris,
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5038098/
